For en ideell gass har vi tilstandsligningen:
PV=nkT
der P er trykk, V er volum, n antall molekyler, k Bolzmans konstant og T temperaturen.
Vi har et apparat med en avstengt mengde luft, et stempel, der vi kan lese av volumet, trykket og temperaturen.
Hvis apparatet hadde vært helt tett og godt isolert, kunne vi gjort forsøk i tre runder:
Men, et er vanskelig å få gode resultater på 2 og 3, så vi nøyer oss med å sjekke 1: Boyles lov.
Volumet av luft er summen av volumet i røret og volumet i trykkmåleren; 2.1.
Når vi leser av en volumenhet på skalaen, for eksempel 5, så skal vi bruke 5+2.1=7.1 volumenheter i beregningen.
Vi lager da en måleserie ved å innstille stempelet på 8 delstreker. (Som da er 8+2.5=10.5 volumenheter.)
Stempelet skyves inn til henholdsvis 7, 6, 5, 4, 3, 2 og 1 delstrek og trykket leses av. (Relativt raskt før luften lekker ut.)
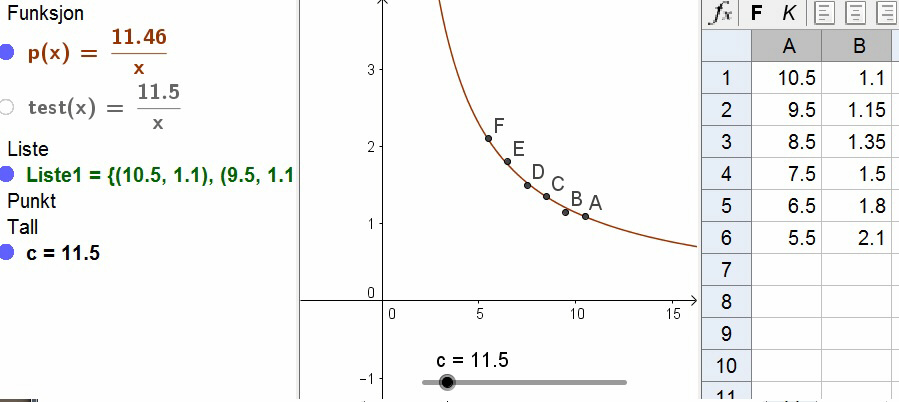
Et kjapt og unøyaktig testforsøk utført av lærer ga resultatet:
| V [streker] | Trykk [bar] |
| 8 som egentlig er: 10.5 | 1.1 |
| 7: 9.5 | 1.15 |
| 6: 8.5 | 1.35 |
| 5: 7.5 | 1.5 |
| 4: 6.5 | 1.8 |
| 3: 5.5 | 2.1 |
Vi kan da gjøre en kurvetilpasning i GeoGebra og teste om PV=c, eller at p(x) = c/x, der p(x) er trykk og x er volum.
I GeoGebra legger vi da ut en testfunksjon:
test(x) = c/x, der c er en glider i området 0 til 100
Kurvetilpasning gjøres så med kommandoen:
p(x) = Reg[Liste1, test],
der Liste1 er punkter vi har laget ved å merke måleresultatene i regnearket, høyreklikke og bruke Lag, Liste med punkt.

Vi ser av grafen at målingene stemmer rimelig bra med Bolyles lov:
PV=const